In enger Kooperation mit unseren klinischen Partnern, der Strahlenklinik, der Neurochirurgischen und Neurologischen Klinik und der klinischen Medizinphysik ist das übergeordnete Ziel unserer neuroonkologischen Forschung, die Tumorbiologie von Hirntumoren umfassend bildgebend zu erfassen und die Ergebnisse in einem translationalen Ansatz für eine bessere Diagnose und Differentialdiagnose und das Therapiemonitoring zu nutzen.
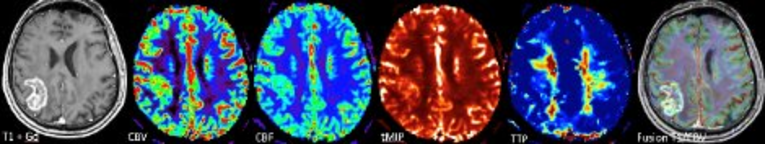
Multiparametrische Bildgebungsverfahren wie die spezielle Diffusions-, Perfusions- und quantitative (suszeptibilitätsgewichtete) MRT-Bildgebung ermöglichen dabei eine „state-of-art“ Betreuung unserer Patientinnen und Patienten hinsichtlich Erstdiagnose (Befundeinordung, „Differentialdiagnose“) und insbesondere in der zuverlässigen Verlaufsbeurteilung von Hirntumoren.
Multiparametrische MRT
Die multiparametrische Hochfeld-MRT kann zum Beispiel Neovaskularisation, Wachstumsdynamik und Metabolismus (Nekrose, Progression, Pseudoprogression, Pseudo-Response) von Hirntumoren charakterisieren. Der multiparametrische Ansatz ermöglich es dabei sogar, „Imaging-Biomarker“ für die pathophysiologischen Prozesse auf zellulärer Ebene zu identifizieren. Aufbauend auf unseren umfangreichen experimentellen und klinischen Vorarbeiten nutzen wir für den Transfer der Ergebnisse in die klinische Anwendung auch innovative KI-Verfahren.
Radiomics
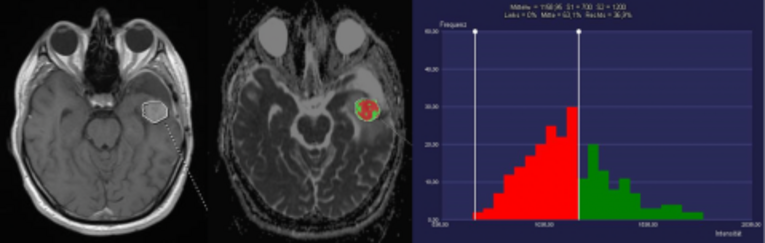
Die Analyse und Kombination von quantitativen Bildmerkmalen (sog. „Radiomics“) ermöglicht hierbei u.a. eine zuverlässigere bildgebende Charakterisierung (Diagnose und Grading) von Hirntumoren. Zum Beispiel können wir Glioblastome von zerebralen Lymphomen mit einer Genauigkeit von 96% differenzieren, obwohl diese Tumorentitäten in den konventionellen MRT-Kontrasten gleich aussehen können.
MRT-basierte, nichtinvasive Darstellung der Mikrovaskulatur und des Metabolismus von Hirntumoren
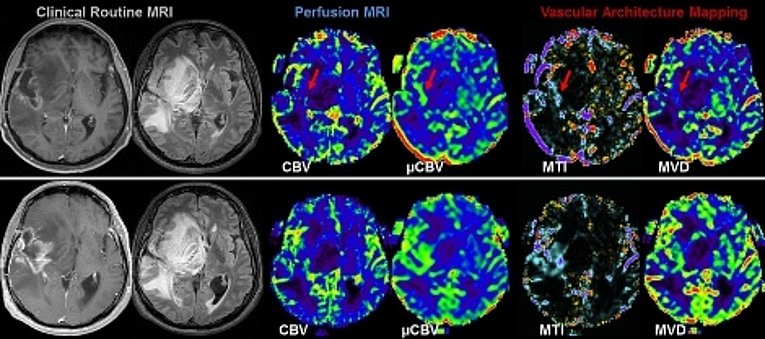
Blutgefäße spielen eine entscheidende Rolle im Entwicklungsverlauf bösartiger Tumore. Im frühen Stadium der Tumorentwicklung wachsen die meisten Läsionen avaskulär bis ein Gleichgewicht zwischen Proliferation und Apoptose erreicht ist, danach setzt meist Neoangiogenese ein. Der Grad der Vaskularisierung korreliert dabei mit der Tumoraggressivität sowie schlechter Prognose beziehungsweise Outcome. Eine Beurteilung der Architektur des Tumorgefäßbetts ist daher von hoher Relevanz für die klinische Beurteilung und der Therapieplanung von Hirntumoren. In interdisziplinärer Zusammenarbeit mit der Neurochirurgischen Klinik und mit finanzieller Unterstützung der Deutschen Forschungsgemeinschaft und internationaler Beteiligung konnten neue Strategien der MRT-Bildgebung und der Bildverarbeitung zur Darstellung der Neovaskularisation von Hirntumoren entwickelt werden. So können neuartige Bewertungsstrategien von MR-Perfusionsdaten und neue MRI-Biomarker etabliert werden, die detailliertere Einblicke in die Komplexität und Heterogenität vaskulärer Veränderungen bei Hirntumoren liefern. Erste Ergebnisse von Untersuchungen bei Patienten mit rezidivierenden Glioblastomen während einer antiangiogenen Monotherapie (Bevacizumab) zeigen dabei, dass die frühe Reaktion (nach einem Monat) auf Bevacizumab durch die Reduktion der kleineren Mikrovaskulatur (etwa 10 μm) dominiert wird. In der 3-Monats-Kontrolle zeigt sich bei den Tumoren zusätzlich eine Reduktion der größeren Mikrovaskulatur (> 20 μm).
Hypoxie ist ein bekannter Auslöser der Neovaskularisation. Es besteht eine starke Beziehung zwischen der Neubildung von Tumorvaskulatur, der Sauerstoff- und Nährstoffversorgung und den Pfaden des Energiestoffwechsels (Warburg Effekt). In enger Zusammenarbeit mit der Klinik für Neurochirurgie konnten wir in einem gemeinsamenen Projekt zur Korrelation von Sauerstoffmetabolismus und Neovaskularisierung zeigen, dass diese beiden Faktoren verglichen mit anderen, herkömmlichen bildgebenden Biomarkern am besten für die Differenzierung des IDH1-Genmutationsstatus bei anaplastischen Gliomen geeignet ist.
Auch bei der Differenzierung von Therapiefolgen (Pseudoprogress) und wahrem Tumorprogress von hochmalignen Gliomen sind diese Techniken in Ergänzung zur Perfusionsbildgebung äußerst hilfreich.
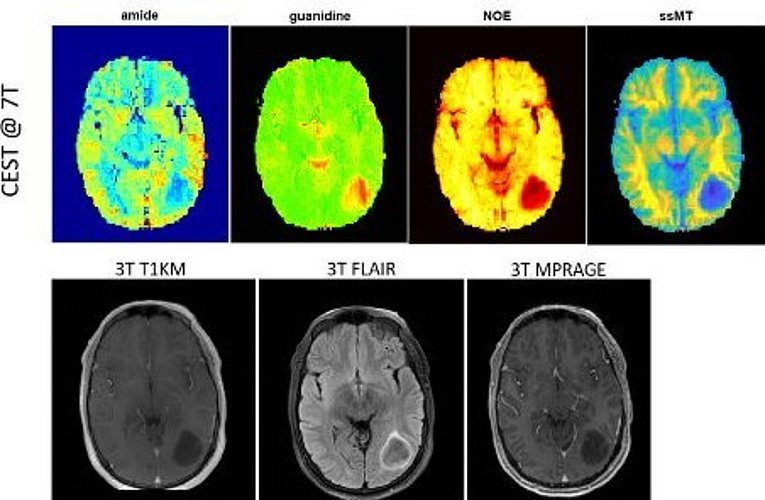
Darüberhinaus ermöglicht CEST MRT die Bildgebung von Molekülen mit verschiedenen austauschenden Gruppen, wie Amidprotonen (-NH), Guanidyl-Protonen (-NH2) oder Hydroxylprotonen (-OH), sowie auch dipolar gekoppelte aromatische und aliphatische Gruppen (CHn). Damit entsteht die Möglichkeit einer völlig neuen nicht-invasiven Bildgebung von intrinsischen Proteinen und Metaboliten von malignen Gliomen, die wir derzeit auf ihr Potential in der klinischen Bildgebung überprüfen.
Ansprechpartner:
PD Dr. med. Manuel Schmidt, Prof. Dr. rer. nat. Moritz Zaiss
Auswahl Literatur:
Goerig NL, Frey B, Korn K, Fleckenstein B, Überla K, Schmidt MA, Dörfler A, Engelhorn T, Eyüpoglu I, Rühle PF, Putz F, Semrau S, Gaipl US, Fietkau R. Early mortality of brain cancer patients and its connection to cytomegalovirus reactivation during radiochemotherapy. Clin Cancer Res. 2020 Feb 14.
Putz F, Mengling V, Perrin R, Masitho S, Weissmann T, Rösch J, Bäuerle T, Janka R, Cavallaro A, Uder M, Amarteifio P, Doussin S, Schmidt MA, Dörfler A, Semrau S, Lettmaier S, Fietkau R, Bert C. Magnetic resonance imaging for brain stereotactic radiotherapy : A review of requirements and pitfalls. Strahlenther Onkol. 2020 May;196(5):444-456.
Hofmann S, Schmidt MA, Weissmann T, et al. Evidence for improved survival with bevacizumab treatment in recurrent high-grade gliomas: a retrospective study with ("pseudo-randomized") treatment allocation by the health insurance provider. J Neurooncol. 2020;148(2):373-379. doi:10.1007/s11060-020-03533-5
Stadlbauer A, Kinfe TM, Zimmermann M, Eyüpoglu I, Brandner N, Buchfelder M, Zaiss M, Dörfler A, Brandner S. Association between tissue hypoxia, perfusion restrictions, and microvascular architecture alterations with lesion-induced impairment of neurovascular coupling. J Cereb Blood Flow Metab. 2020 Aug 12:271678X20947546.
Schmidt M.A., Knott M., Hoelter P., Engelhorn T., Larsson E.M., Nguyen T., Essig M, Doerfler A. Standardized acquisition and post-processing of dynamic susceptibility contrast perfusion in patients with brain tumors, cerebrovascular disease and dementia: comparability of post-processing software. (2019) Br J Radiol. 2019 Oct 16:20190543. doi:10.1259/bjr.20190543. [Epub ahead of print] PubMed PMID: 31617743.
Stadlbauer A, Eyüpoglu I, Buchfelder M, Dörfler A, Zimmermann M, Heinz G, Oberndorfer S. Vascular architecture mapping for early detection of glioblastoma recurrence. Neurosurg Focus. 2019;47(6):E14.